|
羅威威,尤俊
(福建省鍋爐壓力容器檢驗研究院,福建福州350008)
摘要:文中使用熱重分析法研究生物質成型燃料的熱解性質。結果顯示,生物質成型燃料的熱解過程主要分為三個階段:失水干燥、快速熱解與緩慢失重。當升溫速度從5K/min逐漸升高至30K/min時,最大熱解速率由-3.72%/min逐步上升至-19.41%/min,這說明提高升溫速度對熱解有利,熱解曲線向高溫區移動。采用Coats-Redfern模型對成型燃料的熱解過程進行擬合,發現一級動力學模型可描述成型燃料的熱解過程,且活化能在58kJ/mol~69kJ/mol之間,表明生物質成型燃料的熱解過程很容易進行。
隨著化石能源的日益枯竭與環境問題的愈發嚴重,生物質作為便于運輸與儲存的可再生能源,其能量轉換與清潔利用受到了廣泛的關注,生物質能源的開發已成為了重要研究方向[1]。生物質成型燃料是采用農林廢棄物作為原料,通過粉碎、干燥、機械加壓等過程,將密度低的原料制成高密度、高熱值的生物質固體燃料,它也可以作為生物質熱解、氣化的燃料,以實現生物質燃料的高效利用[2]。
生物質熱解是在隔絕空氣條件下,利用熱能將大分子有機物轉化為小分子物質的過程,是高效利用生物質能的方式之一[3,4]。目前大量熱解氣化的研究集中于生物質單體,如秸稈、農林廢棄物等,對于成型燃料的研究較少。為了推廣生物質熱解氣化爐,提高生物質資源利用率,有必要對生物質成型燃料的熱解過程與機理進行研究。
文中對不同升溫速率下生物質的熱解過程進行研究,并采用Coats-Redfern法分析熱解動力學,求出活化能、頻率因子等動力學參數,為成型燃料的熱化學轉化及轉換設備的開發設計提供基礎數據。
1材料與方法
1.1試驗原料
生物質成型燃料源于福建省福州市某生物質燃料生產廠家。試驗原料首先經過烘箱烘干后,在空氣中水分平衡,破碎后篩出進行工業組分、元素及熱值分析,分析結果見表1。表1也列出了煙煤的指標進行對比,煙煤數據源于福建省鍋爐壓力容器檢驗研究院的日常檢測。
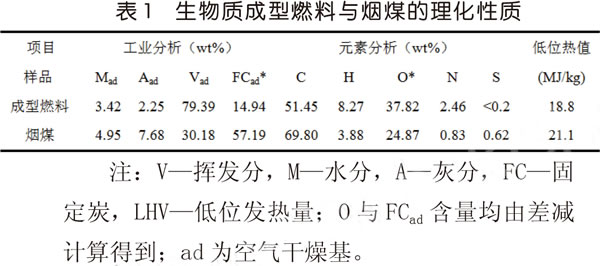
由燃料理化性質分析可得,成型燃料的揮發分為79.39%,遠高于煙煤的30.18%;固定炭為14.94%,遠低于煙煤;由于成型燃料的揮發分高,固定炭低,O元素含量高,導致成型燃料的低位熱值比煙煤偏低。
1.2試驗裝置及運行參數
熱重分析采用北京博淵的微機差熱天平。每次試驗生物質粉末用量(10.0±0.5)mg,通入高純氮氣(99.999%)作為保護氣,流量為100mL/min,升溫速率分別為5K/min、10K/min、20K/min、30K/min,電腦自動記錄熱解過程的熱重曲線(TG)和微分熱重曲線(DTG)。
1.3分析方法
生物質燃料的工業組分,包括水分(Mad)、灰分(Aad)與揮發分(Vad)均采用長沙開元5E-MAG6700型工業分析儀測定;C、H、N元素采用長沙開元的5E-CHN2000型元素分析儀測定;S元素采用長沙三德SDS516型測硫儀測定;熱值采用長沙開元5E-KCIV型快速量熱儀測定,O元素與固定碳(FCad)含量均通過差減法計算得出。
2結果與討論
2.1生物質成型燃料的熱解過程
圖1顯示了成型燃料在升溫速率為5K/min下的TG-DTG曲線。
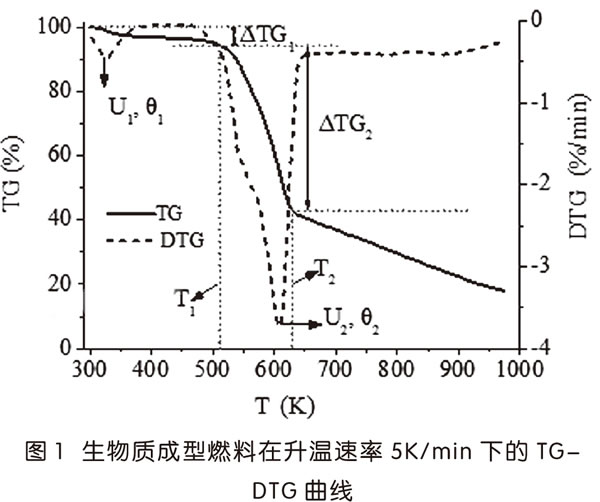
由圖1可知,可將生物質成型燃料的熱解過程分為三個時期:
第一時期是從室溫至517.5K(T1):當溫度升至381.4K,原料失重率為3.31%,幾乎等于成型燃料的含水率(3.42%),這個部分主要是失水,DTG曲線也出現較小的失重峰;在381.4K-517.5K間,TG曲線緩慢下降,蠟質成分發生軟化;第一階段的總失重率(ΔTG1)為7.07%。
第二時期是517.5K(T1)-625.1K(T2):TG曲線急劇下降,是生物質熱解的主要階段,失重率(ΔTG2)為50.13%;DTG曲線出現最大的失重速率峰,最高失重速率U2為-3.72%/K(“-”代表失重,下同),對應峰溫θ2為608.9K。該階段是纖維素、半纖維素及木質素有機組分的裂解產生大量揮發分。
第三時期是在625.1K(T2)后,該階段TG曲線下降速率變緩,失重速率基本維持在-0.39%/K至-0.42%/K。該階段主要是木質素熱解,并生成較多的炭。
2.2升溫速率對生物質成型燃料熱解的影響
圖2分別顯示了成型燃料在5K/min、10K/min、20K/min與30K/min升溫速率下的TG-DTG曲線。
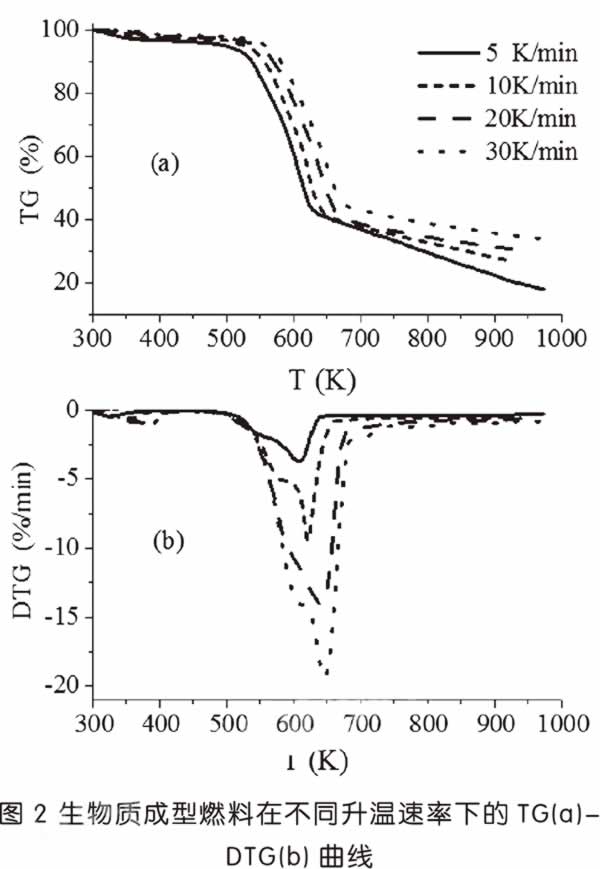
圖2經整理后,獲得成型燃料在4個升溫速率下的熱解特征參數,見表2。
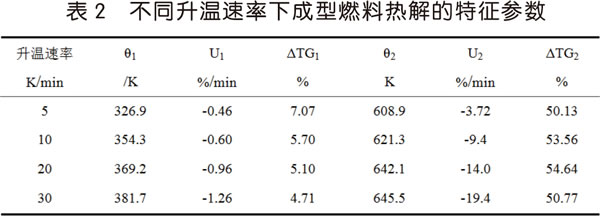
當升溫速率從5K/min升高至30K/min時,TG曲線整體向高溫區移動,熱解過程出現了滯后,ΔTG1逐漸降低,ΔTG2基本相等,在相同的溫度下,升溫速率越高,失重就越少;DTG曲線的兩個熱解峰的峰值速率U1與U2分別從-0.46%/min與-3.72%/min升高至-1.26%/min與-19.4%/min,熱解速率升高且主熱解區峰寬變大,說明提高升溫速率有利于熱解反應迅速進行;峰值溫度θ1與θ2分別從326.9K與608.9K升高至381.7K與645.5K,DTG曲線也隨之向高溫區移動,傳熱滯后效應導致峰值溫度θ升高。
2.3生物質成型燃料的熱解動力學
動力學分析主要針對的是第二時期的主熱解階段,利用熱重數據即可求出成型燃料在各個升溫速率下的動力學參數。研究者已經得出多種動力學模型[5,6]。文中采用Coats-Redfern法計算活化能E及頻率因子A。
生物質熱解動力學方程的一般形式為:

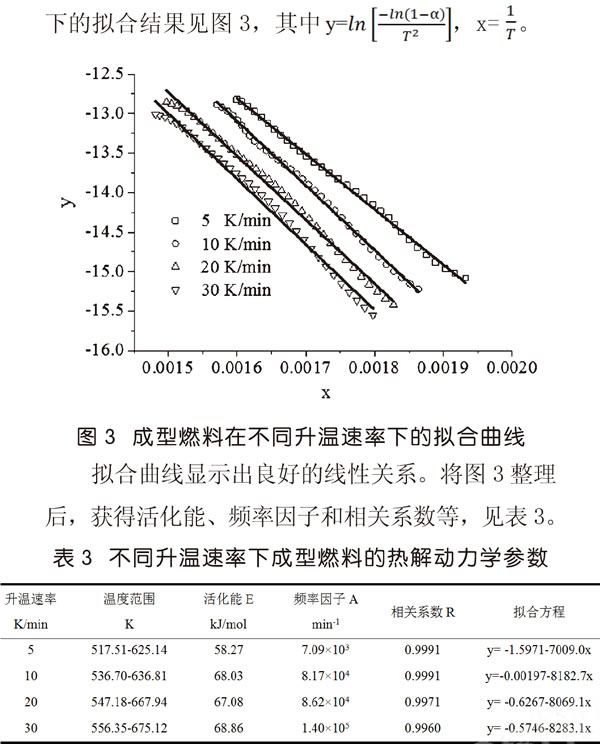
對于主熱解階段,當反應級數為1時,用TG數據模擬動力學曲線,獲得高的相關系數,R2為0.996以上,說明采用一級動力學模型來描述成型燃料的主要熱解階段是可行的,采用Coats-Redfern法求得的活化能數據是可靠的。成型燃料的活化能在58kJ/mol-69kJ/mol之間,數值較低,表明成型燃料的熱解反應比較容易進行,而且升溫速率對表觀活化能的影響并不大,數據之間的差異主要由于模型計算誤差產生。
3結論
文中研究了生物質成型燃料的熱解性質及反應動力學,獲得以下三點結論:
(1)成型燃料的熱解過程存在三個階段:干燥、快速熱解與緩慢分解。
(2)隨著升溫速率的逐漸提高,熱解速率也隨之提高,有利于熱解過程;而傳熱滯后效應引起TG與DTG曲線向高溫區移動。
(3)采用一級動力學模型擬合出的曲線相關系數均大于0.996,表明成型燃料的熱解過程符合一級動力學模型,而且活化能低,熱解反應容易進行。
結果表明,成型燃料可通過熱解氣化方式提高生物質的能源利用率,該研究可為開發用于生物質成型燃料的熱解氣化設備提供熱力學基礎數據。
參考文獻
[1]孫軍,鄒玲.木廢料燃燒過程中及其影響因素分析[J].工業鍋爐,2002(6):24-27.
[2]盛奎川,吳杰.生物質成型燃料的物理品質和成型機理的研究進展[J].農業工程學報,2004,20(2):242-245.
[3]蔡曉鋒,張濤.生物質熱解技術的現狀、發展趨勢及研究[J].工業鍋爐,2011(2):10-12.
[4]蘇毅,朱惠春,張金亮,等.城市垃圾熱化學轉化處理技術進展與應用[J].工業鍋爐,2015(1):7-14.
[5]Hu S,Jess A,Xu M.Kinetic study of Chinese biomass slow pyrolysis:comparison of different kinetic models[J].Fuel,2007,86(17-18):2778-2788.
[6]Rahman Y E.Assessment of oral 1,2-dimethyl–3-hydroxypyrid–4–one (L1) in different ferrikinetic models in animals and humans[J].British Journal of Haematology,1991,77(3):440-442. |
